Druhý termodynamický zákon
Druhý termodynamický zákon (též druhý termodynamický princip, druhá hlavní věta termodynamická nebo nesprávně druhá termodynamická věta) je důležitý termodynamický zákon určující přirozený směr, kterým přírodní procesy probíhají.
První termodynamický zákon je zákonem kvantitativním, který říká, že všechny druhy energie jsou kvantitativně ekvivalentní (rovnocenné) a vzájemně je lze transformovat. Tedy z hlediska tepelné energie ji lze jako formu energie přeměňovat na jiné formy.
Druhý termodynamický zákon je kvalitativní a uvádí, jak probíhají tepelné děje v případě, že je tepelnou energii možno přeměňovat s určitým omezením. Je empirický a pravděpodobnostní.
Veličina, která charakterizuje směr vývoje systému se nazývá entropie.
Vratné a nevratné děje
První termodynamická věta představuje zákon zachování energie. Podle tohoto zákona nemůže energie samovolně vznikat nebo zanikat, ale může se pouze měnit na jiný druh energie. Takže např. spotřeba jistého množství tepla se projeví mechanickou prací, vykonáním určité práce vznikne odpovídající množství tepla apod.
Mohlo by se tedy zdát, že přeměna energie může probíhat neomezeně v obou směrech. Ze skutečnosti však víme, že to není pravda. Práci lze téměř beze zbytku přeměnit (např. třením) na teplo. Příkladem může být roztočené kolo na hřídeli, které se po určitém čase vlivem tření zastaví, přičemž dojde k ohřátí ložiska a hřídele kola. Neznáme však žádný podobně jednoduchý způsob, kterým by bylo možno využít tepelnou energii kola k jeho roztočení.
Při styku dvou těles, která tvoří izolovanou soustavu, bude teplo samovolně přecházet z tělesa teplejšího na těleso chladnější. Tento proces potrvá tak dlouho, dokud nedojde k vyrovnání teplot obou těles, tj. k rovnovážnému stavu. K dosažení počátečního stavu by bylo nutné, aby teplo samo přecházelo z tělesa chladnějšího na těleso teplejší. Takový děj však v izolované soustavě nemůže nastat.
Takové děje (stavové změny), které probíhají bez vnějšího působení pouze jedním směrem, nikoli však opačným, se nazývají změny nevratné (ireverzibilní). Děj, který může probíhat v obou směrech, se nazývá vratný (reverzibilní).
Nevratnost změny nespočívá v tom, že by nebylo možné dosáhnout výchozího stavu soustavy, ale v tom, že tohoto stavu nelze dosáhnou pouhým obrácením postupu. Říkáme také, že nepostupujeme po stejné cestě. K dosažení počátečního stavu soustavy je třeba vynaložit vnější energii, tzn. energii ze zdroje, který není součástí izolované soustavy.
Prakticky všechny děje probíhající v přírodě lze považovat za nevratné. Vždy se totiž část mechanické energie mění na teplo, popř. dochází ke styku tělesa teplejšího s chladnějším. Vratné děje jsou tedy jen určitou idealizací, která nám pomáhá pochopit přírodní jevy.
Formulace zákona
Slovní formulace obvykle konstatuje existenci jednoho typu nevratných dějů, přičemž nevratnost ostatních dějů lze z této definice odvodit. Existují tak různé, ale obsahově rovnocenné formulace této věty.
- Clausiusova formulace
Teplo nemůže při styku dvou těles různých teplot samovolně přecházet z tělesa chladnějšího na těleso teplejší.
Teplo tedy nepřechází samovolně z prostředí o nižší teplotě do prostředí s vyšší teplotou. Tento přechod se v praxi nepotvrdil, ale není vyloučený.
- W. Thomsonova a Planckova formulace
Nelze sestrojit periodicky pracující tepelný stroj, který by trvale konal práci pouze tím, že by ochlazoval jedno těleso, a k žádné další změně v okolí by nedocházelo.
Z praxe víme, že všechny druhy energií lze přeměnit na teplo. Obrácený přechod beze zbytku je z hlediska pravděpodobnosti nerealizovatelný a v praxi jej nepozorujeme.
- W. Thomsonova a Ostwaldova formulace
Nelze sestrojit perpetum mobile druhého druhu.
Není možné sestrojit periodicky pracující stroj, který by jen přijímal teplo od určitého tělesa (ohřívače) a vykonával stejně velkou práci. Každý takový stroj pracuje tak, že přijímá od ohřívače teplo Q1 a chladiči odevzdá teplo Q2 (Q2 < Q1), přičemž vykoná práci W=Q1-Q2.
- Carnotova formulace
Žádný tepelný stroj pracující mezi dvěma teplotami nemůže mít vyšší účinnost než Carnotův stroj pracující mezi stejnými teplotami.
- Carathéodoryho formulace
V každém okolí každého stavu teplotně homogenního systému existují stavy, k nimž se není možno libovolně přiblížit adiabatickou změnou stavových parametrů.
Existují tedy adiabaticky nedosažitelné stavy.
----------------------------------------------------------------------------------------------
Adiabata, nebo izoentropa je křivka popisující změny stavových veličin během adiabatického děje.
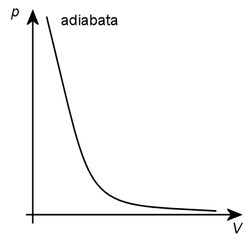
Ve stavovém diagramu pV (závislost tlaku na objemu plynu) má adiabata exponenciální průběh podle rovnice:
p.V^\kappa = const
- P - tlak plynu
- V - objem plynu
- κ Poissonova konstanta
Ve stavovém diagramu TS (závislost teploty na změně entropie) má adiabata lineární průběh podle rovnice:
\Delta S = const
- ΔS - změna entropie plynu
Entropie se podél adiabaty nemění, odtud je odvozen i její alternativní název izoentropa.
